Arbeitsgruppenleiter
Spermatogenese – Analyse von Einzelzellen
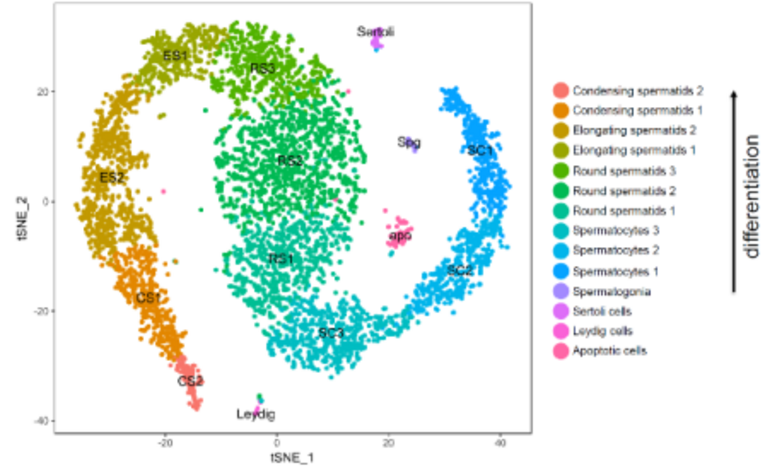
Während der Spermatogenese differenzieren diploide spermatogonale Stammzellen zu reifen, haploiden Spermien. Sie durchlaufen hierbei einen komplexen Differenzierungsprozess. Der korrekte Ablauf dieses Prozesses sowie die Kontrolle der Integrität des Erbgutes hierbei (insbesondere die strikte Kontrolle transposabler Elemente) ist für Quantität und Qualität der entstehenden Spermien von größter Bedeutung. Probleme hierbei führen letztlich zu männlicher Infertilität, die ca. 50% aller Infertilitätsfälle ausmacht und in 15-30% auf genetische Veränderungen zurückzuführen ist. Durch Single Cell RNA-Sequencing konnten wir als Erste das Expressionsprofil der verschiedenen Zellpopulationen im Hoden der Maus charakterisieren und diese klassifizieren (Abb. #). Ziel der Arbeitsgruppe ist es nun auf Basis dieser Methodik die Differenzierung der Keimzellen, die Expression bzw. Expressionskontrolle von Retrotransposons sowie die Ursachen verschiedener Infertilitätsformen bei Maus und Mensch aufzuklären. Im Mittelpunkt stehen hierbei Expressionsanalysen, die Analyse epigenetischer Prozesse sowie die Untersuchung möglicher transgenerationaler epigenetischer Vererbung.
Der epigenetische Reader PHF13
Des Weiteren arbeitet unsere Arbeitsgruppe an SPOC1 (PHF13). PHF13 kodiert für ein Protein, das über eine PHD-Domäne, zwei PEST-Domänen sowie eine nukleäre Lokalisationssequenz verfügt und besonders stark in einigen rasch proliferierenden unreifen Zelltypen, wie zum Beispiel den Spermatogonien, exprimiert wird. PHF13 bindet an Histonmethylierungen und stellt damit einen „reader“ epigenetischer Modifikationen dar. Es ist aktiv an der Mitose beteiligt, und übt direkten Einfluss auf den Grad der Chromatinverpackung und die korrekte Chromosomenkondensation während der Zellteilung aus. PHF13 verschiebt die DNA-Doppelstrangbruch-Reparatur von Non-homologous end joining (NHEJ) zu homologer Reparatur (HR) und spielt eine Rolle in kotranskriptionellem Splicing und der Regulation von RNA Polymerase II.
Homozygote Phf13-/--Tiere werden in deutlich geringerer Zahl geboren und sind lebensfähig, entwickeln aber nach der Pubertät schnell einen progressiven Verlust von Keimzellen, was letztlich zu Testishypoplasie und Infertilität führt. Die Ursache hierfür liegt in einem Differenzierungsdefekt der spermatogonalen Stammzellen sowie einer erhöhten Apoptoserate im Pachytänstadium der Meiose. Hier kommt es zu einer Fehlexpression X- und Y-chromosomaler Gene. Wir konnten zeigen, dass die meiotische Inaktivierung der Geschlechtschromosomen (meiotic sex chromosome inactivation, MSCI) gestört ist. Aufgrund der möglichen Funktion von PHF13 als epigenetischer „reader“ und Vermittler von Histonmodifikationen sind hierbei Veränderungen epigenetischer Modifikationen bzw. Bindungen hieran beteiligter Proteine wahrscheinlich. Darüber hinaus konnten wir zeigen, dass PHF13 an der Regulation von Retrotransposons in der Keimbahn beteiligt ist.
Im Fokus der Arbeitsgruppe steht daher die weitere Aufklärung der Funktion von PHF13 bei der epigenetischen Kontrolle von Differenzierungsprozessen sowie der Regulation von Retrotransposons in der männlichen Keimbahn.
Mitarbeiter
Sören Lukassen, Doktorand
Elisabeth Bosch, Doktorandin
Johannes Bruss, medizinischer Doktorand
Timo Kunert, Masterstudent
Lisa Lou Schulze, Masterstudentin
Aylin Lindemann, Masterstudentin
Katrin Münzebrock, Bachelorstudentin